L’usage de la technologie Microfluidizer dans la production de nanoparticules polymères.
Cet article a pour but de fournir une vue d’ensemble de l’usage des appareils Microfluizer lors du développement et la production nanoparticules polymères.
Le Microfluidizer est largement reconnu dans la communauté des chercheurs comme la technologie idéale pour la production de nanoparticules polymères. Ce texte décrit notamment les principaux facteurs à prendre en compte lors de la mise en oeuvre du processus. Les nanoparticules polymères sont utilisées lors de la production de nanoparticules solides lipidiques qui permettent d’améliorer l’absorption par les cellules.

Figure 1 : Image de microscopie électronique en transition de nanoparticules polymères créées grâce à la technologie Microfluidizer
Quels sont les avantages des nanoparticules polymères ?
L’intérêt porté aux nanoparticules polymères biodégradables est de plus en plus important depuis une dizaine d’années. En effet, elles présentent de nombreux atouts :
- Combiner différentes substances thérapeutiques.
- Cibler certaines composantes.
- Protéger les principes actifs contre les altérations.
- Maîtriser la diffusion des substances dans l’organisme.
- Prendre en compte les moyens de diagnostique.
- Possibilité d’une stérilisation intégrale par filtration.
Première étape : Déterminer la formule.
La phase aqueuse : eau + tensioactif
Le tensioactif le plus communément utilisé est l’alcool polyvinylique, mais plusieurs chercheurs ont obtenu de bons résultats avec l’utilisation de tensioactif polymériques comme le polysorbate et le polyoxyethylène ou encore certains phospholipides comme le 1,2-distéaroyl-sn-glycéro-3-phosphocholine.
Les concentrations de tensioactif sont généralement assez faibles, de l’ordre de 0,1 à 1% de la fraction massique.
La phase huileuse : solvant aqueux non-miscible + polymère + autres composants (principes actifs, agents de contraste…etc).
Les solvants les plus couramment utilisés sont l’éthyle d’acétate et le chlorure de méthylène. Plusieurs facteurs doivent être pris en compte quand au choix du solvant.
La miscibilité dans l’eau : En général, moins le solvant est miscible dans l’eau mieux c’est. Si la miscibilité est élevée (l’éthyle d’acétate se dilue à une concentration de 8,3g/100mL) la majorité des chercheurs préfèrent saturer la phase aqueuse de solvant.
Le point d’ébullition : Généralement les solvants sont éliminés par évaporation. Cette opération est plus facile avec les solvants qui ont un point d’ébullition faible mais cela rend l’ensemble du processus plus complexe. En effet, en utilisant des solvants volatils (le dichloromethane a un point d’ébullition à 39°C) il est plus difficile de conserver l’échantillon à basse température au cours de toutes les étapes du processus afin d’éviter toute évaporation ou ébullition soudaine.
La toxicité : Certains solvants montrent d’excellentes propriétés pour ce type d’utilisation comme le chloroforme ou le dichlorométhane mais ils s’avèrent carcinogéniques et causent des troubles du système reproducteur.
Le polymère le plus fréquemment utilisé est l’acide poly(lactique-co-glycolique) (PLGA). Plusieurs types de PLGA peuvent être utiles pour modifier les caractéristiques essentielles du polymère : le taux de dissolution, la compatibilité avec les principes actifs…etc. La masse de la molécule et le ratio entre acide lactique et acide glycolique peuvent être contrôlés. De plus, les co-polymères de PLGA peuvent servir à apporter des propriétés spécifiques. Le chitosane, par exemple, peut être utilisé pour cibler des zones spécifiques de l’organisme. Les chercheurs ont même établit des liens entre les ingrédients actifs et le polymère. D’autres polymères biodégradables comme polycaprolactone et le polyester ont également été utilisés.
Différents types de substances peuvent être encapsulés à l’intérieur du polymère.
Les substances pharmaceutiques actives.
Grâce à la polyvalence des nanoparticules polymères, des substances pharmaceutiques actives ont été développées pour un grand nombres d’indications. Il est fréquent que les chercheurs utilisent un mélange d’ingrédients actifs. Il est alors primordial que chacun de ces éléments soit compatible avec le polymère.
Les substances servant au diagnostique.
Les exhausteurs de contraste peuvent être encapsulés dans les mêmes particules que les principes actifs.
Cela peut servir à s’assurer que la charge de principes actifs soit bien délivrée dans la zone désirée. La combinaison de composants actifs et de composants servants au diagnostique est un champs d’étude à part entière : la théranostique.
Les autres éléments.
Bien d’autres composants peuvent être utilisés en fonction des objectifs. Les chercheurs utilisent des particules para-magnétiques pour un meilleur ciblage. D’autres font usage d’oxydes métalliques qui sont activés pour délivrer un traitement par chaleur thérapeutique de façon ciblée.
Deuxième étape : Détermination du processus.
Ajouter la phase huileuse à la phase aqueuse.

Figure 2 : Pré-mélange avant utilisation de l’agitateur à hélices.
Mélangez en utilisant un agitateur à hélices pour obtenir un pré-mélange stable. Le pré-mélange doit être stabilisé suffisamment longtemps pour être utilisé avec le Microfluidizer.

Figure 3 : Pré-mélange après utilisation de l’agitateur à hélices

Figure 4 : Microfluidizer LM10
Transformez le pré-mélange grâce au Microfluidizer. Les paramètres les plus cruciaux dans le processus sont le type de chambre, la pression utilisée, la température et le nombre de passages.

Figure 5 : Alicotes suite à 1, 2 et 5 passages dans le LM10
Troisième étape : L’extraction du solvant

Figure 5 : Evaporation du solvant dans les échantillons.
Il existe différentes méthodes pour extraire le solvant du mélange après la création des nanoparticules. La méthode la plus simple est de permettre au solvant de s’évaporer par la hotte au cours du mixage.
Les autres méthodes impliquent l’usage de différents techniques de remplacement de solvants, comme l’utilisation d’une ampoule à décanter ou d’un évaporateur rotatif.
Techniques d’analyse
Les nanoparticules polymères sont souvent analysées selon la taille des particules. De ce fait, on utilise généralement la technique de diffusion de la lumière, en particulier la diffusion dynamique du fait de sa capacité intrinsèque à pouvoir mesurer les particules les plus petites. La microscopie optique, la microscopie électronique à balayage ainsi que la microscopie électronique en transition peuvent également être utilisées pour analyser les particules.
Résultats
Tableau 1 : Résultats selon le Zetasizer Nano-S de Malvern
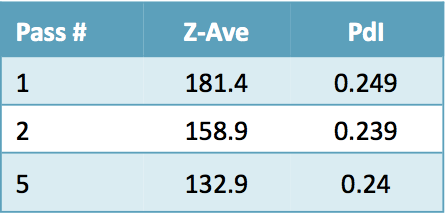
Comme nous pouvons le constater dans la superposition des couches et les données relatives à la taille des particules, la taille des gouttelettes de polymère a diminué, passant de 181 nm après le premier passage à 133 nm après cinq passages dans le Microfluidizer.
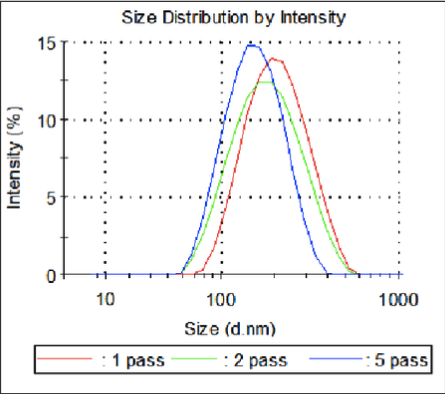
Figure 7 : Distribution des tailles de particules selon les couches
Autres usages des nanoparticules polymères
La technologie Microfluidics peut également servir à créer des pores à l’intérieur des polymères qui peuvent être utilisés pour encapsuler des actifs hydrophiles.

Figure 8 : Image de microscopie électronique en transition de nanoparticules polymères poreuses


