Broyage cellulaire avec homogénéisateur haute pression
Récapitulatif des rapports de recherche sur le broyage cellulaire à l’aide d’un homogénéisateur haute pression Microfluidics.
Homogénéisateur Microfluidics et traitement de la levure
Ce rapport est un bref récapitulatif d’un article intitulé «Evaluation of the Microfluidizer for Cell Disruption of Yeast and Chlorella», de E. Uera-Santos, C.D. Copple, EA Davis et WG. Hagar. La température, la pression, le pH et la composition du milieu sont essentiels à l’intégrité et au rendement des produits isolés après un broyage cellulaire.
Les méthodes conçues à l’origine pour un traitement de faible ampleur sont souvent difficiles et coûteuses à développer, et ne respectent pas ces critères de contrôle essentiels. Lorsqu’un projet doit mener à une production intégrale, le choix du processus de broyage cellulaire au début du développement peut affecter de manière significative la valeur escomptée et la viabilité du projet en question.
Traitement de la levure par homogénéisation
La levure (Saccharomyces cerevisiae) utilisée dans le cadre de cette étude a été gracieusement fournie sous forme de pain surgelé par Miller Brewing Company, et a été remise en suspension à 11% de solides dans une solution saline tamponnée au phosphate.
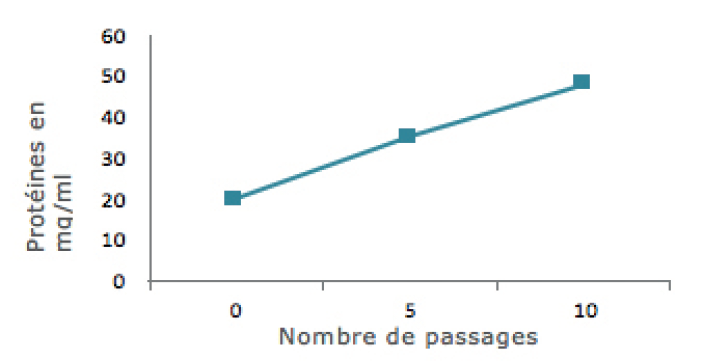
Solubilisation des protéines en augmentant le nombre de passages à 20000 psi et à 10°C (microfluidiseur à 20000 psi)
Conclusion
Plus rapide et plus simple à utiliser. Le Microfluidizer™ a été capable de détruire doucement les cellules et de libérer 2,5 fois plus de protéines solubilisées.
Homogénéisateur et E.coli
Ce rapport est un bref récapitulatif d’un article intitulé :
«Characterization of E. coli Cell Disintegrates from a Bead Mill and High Pressure Homogenizers», de Irene Agerkvist et Sven-Olof Enfors. Institute for Surface Chemistry, Box 560Z S-114 86 Stockholm, and Department of Biochemistry and Biotechnology, The Royal Institute of Technology, S-100 44 Stockholm, Sweden
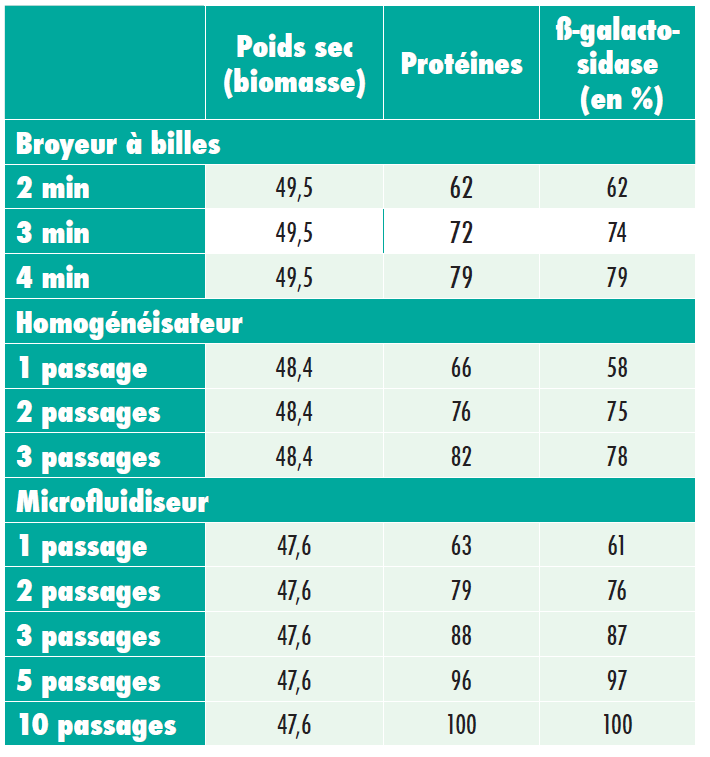
Cette publication compare les performances de trois méthodes de broyage cellulaire : un microfluidiseur, un broyeur à billes, et un homogénéisateur à haute pression (HPH). Quatre paramètres ont été étudiés lors de l’évaluation :
- La libération de protéines, qui est généralement l’objectif du broyage cellulaire.
La répartition de la taille des particules, qui influence la purification des protéines nécessaires.
La viscosité, qui constitue également un facteur des étapes de filtration et de centrifugation.
L’historique de températures des suspensions cellulaires. Les températures plus élevées dénaturent les protéines.
Viscosité
La viscosité peut différer considérablement en fonction de la méthode utilisée.
La viscosité des cellules désintégrées après un passage par l’homogénéisateur est très élevée, mais diminue rapidement lors des passages suivants.
Le broyage cellulaire à l’aide du microfluidiseur donne des cellules désintégrées qui présentent une viscosité assez faible dès le premier passage, qui diminue encore plus lors des passages suivants.
Filtration
Les cellules désintégrées qui proviennent du microfluidiseur présentent les temps de filtration les plus courts.
Le microfluidiseur assure globalement une meilleure séparation des cellules désintégrées lors de centrifugation, par rapport à l’homogénéisateur. Les passages suivants par l’homogénéisateur rendent la séparation moins bonne.
Libération de protéines avec l’homogénéisateur Microfluidics
Le microfluidiseur offre un taux de libération de protéines global plus élevé, qui atteint son apogée au bout de 5 passages environ.
Température
Agerkvist et Enfors ont constaté des températures beaucoup plus élevées après le traitement au sein de l’homogénéisateur, par rapport au microfluidiseur. C’est pourquoi le microfluidiseur produit le plus d’enzymes ß-galactosidase. Les températures de sortie de 40 à 50°C ne sont pas toujours inacceptables, étant donné que la dénaturation thermique des protéines dépend de la durée et de la température. Le temps de séjour dans le microfluidiseur (25 ms à 40 ms) est beaucoup plus court que dans un homogénéisateur.
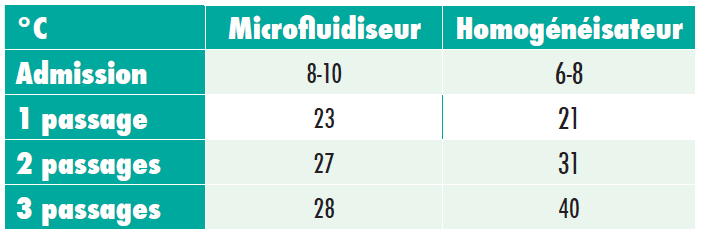
L’homogénéisateur chauffe l’échantillon à une température plus élevée, et plus longtemps — c’est pourquoi une dénaturation plus importante peut être observée au sein des données de rendement.
Répartition de la taille des particules
Le temps de séjour dans le broyeur à billes n’a pas eu beaucoup d’influence sur la répartition de la taille des particules. Le broyeur à billes a créé des pics comparables, de grande taille et de taille moyenne. L’homogénéisateur a créé un pic de taille moyenne, mais également un pic de particules plus petites qui créent des problèmes de viscosité et de filtration. Le microfluidiseur a produit un seul pic de taille moyenne, qui a provoqué une faible viscosité et une meilleure séparation.
Conclusion
Les trois méthodes de désintégration assurent quasiment le même taux de libération de protéines et d’enzymes, mais des taux de désintégration cellulaire considérablement différents, qui influencent la centrifugation et la filtration. La répartition des particules de petite et de grande taille pose des problèmes pendant la purification. Les petites particules sont difficiles à séparer des protéines par centrifugation. La répartition des particules de grande taille provoque une obstruction des filtres.
Le microfluidiseur garantit
- Un taux de rendement de protéines plus élevé
Des durées de filtration plus courtes
Une viscosité moins élevée
Une meilleure séparation que l’homogénéisateur
Des températures moins élevées que l’homogénéisateur
Homogénéisateur et broyage cellulaire
Ce rapport est un bref récapitulatif d’un article intitulé «Evaluation of the Microfluidizer for Cell Disruption Purification of Cytochrome C Oxidase from Microfluidizer Processed Yeast», de E. Llera-Santos, E.A. Davis, S. Ackerman et W.G. Hagar.
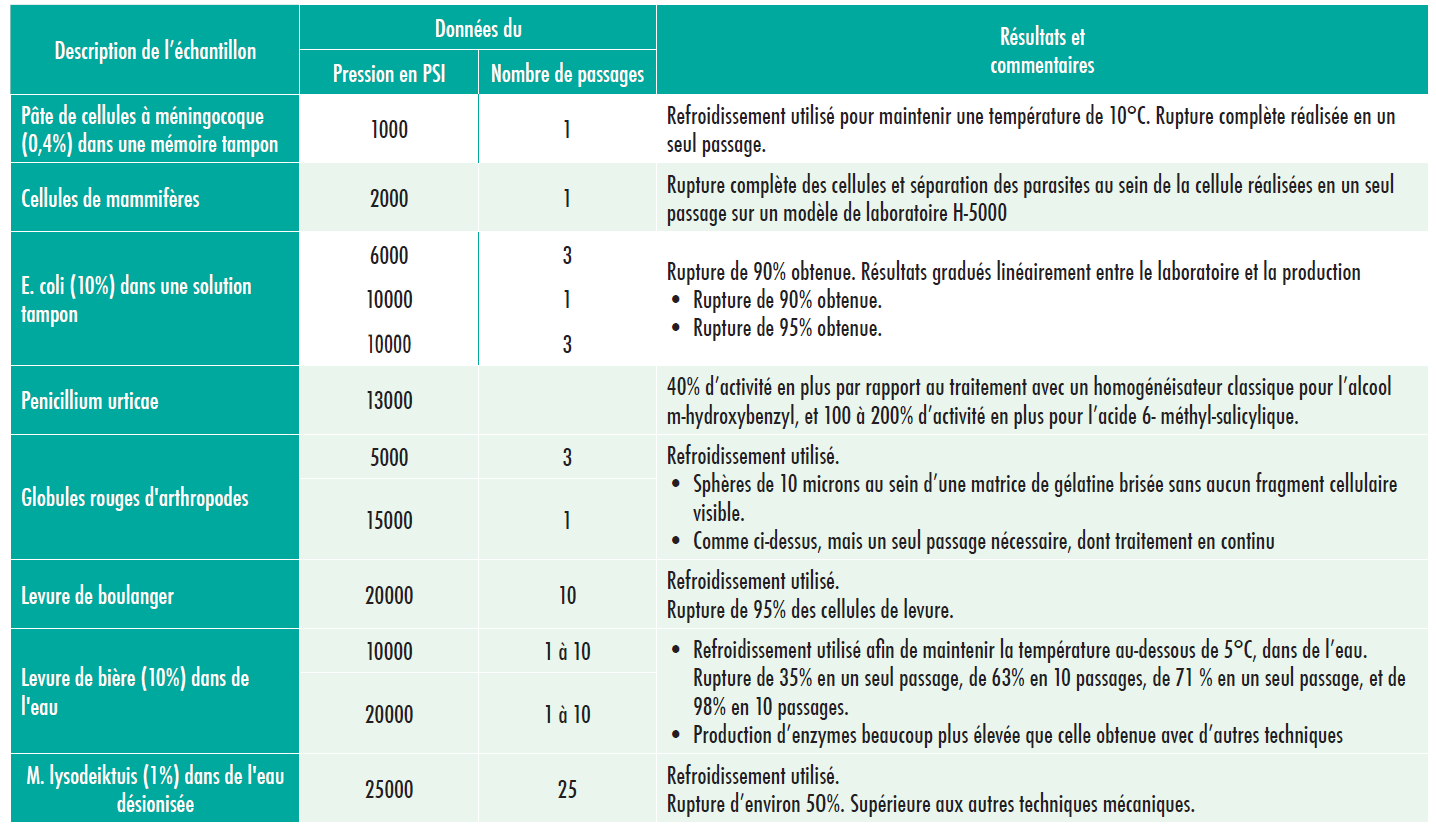
Les conditions de broyage de la levure (Saccharomyces cerevisiae) les plus efficaces ont été développées et consignées dans le récapitulatif de rapport de recherche # 1. Dans le cadre de cette étude, le cytochrome d’enzyme c oxidase sensible à la température (EC 1.9.3.1.) a été isolé, et son activité a été évaluée à l’aide de procédures standard.
La protéine solubilisée a été évaluée à l’aide d’un essai standard Bio-Rad, et le cytochrome c oxidase a été évalué selon une méthode spectrophotométrique standard.
Traitement par homogénéisation
Ces expériences ont débuté avec un volume semi-industriel de 10 litres de levure de boulanger dans un milieu de culture. Dans le cadre de cette étude, le cytochrome d’enzyme c oxidase sensible à la température a été isolé, et son activité a été évaluée à l’aide de procédures standard. La suspension a été refroidie à 4 à 6 °C avant de procéder au traitement.
Conclusion
Le microfluidiseur a fourni environ 3 fois plus de protéines sous-mitochondriales (SMP) malgré un broyage initial légèrement moins important, ce qui indique une perte ou un endommagement de quelques particules pendant le traitement.

Homogénéisateur et récupération de protéine
Ce qui suit est extrait des données développées par le Dr. Paul Sallis of the Research and Development Center, University of Kent England.
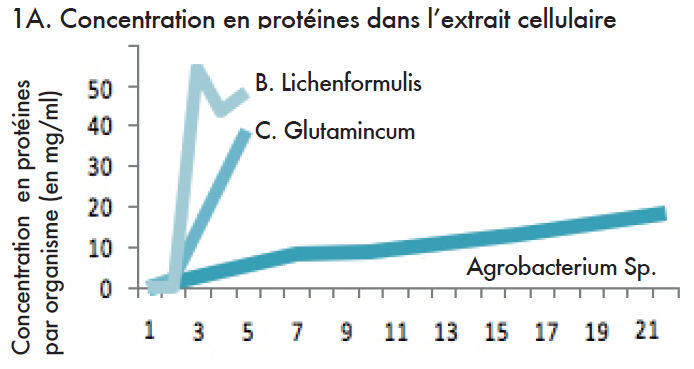
Cette série d’applications illustre l’effet du microfluidiseur sur la récupération de protéines à partir de Agrobacterium Sp., C. Glutamincum, et de B. Lichenformulis.
Expérience d’homogénéisation n°1
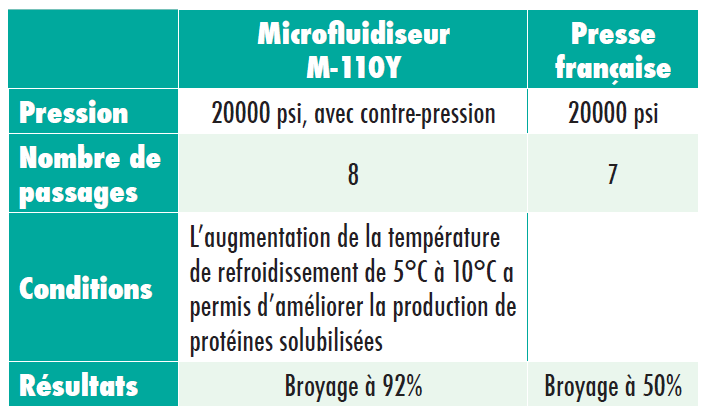
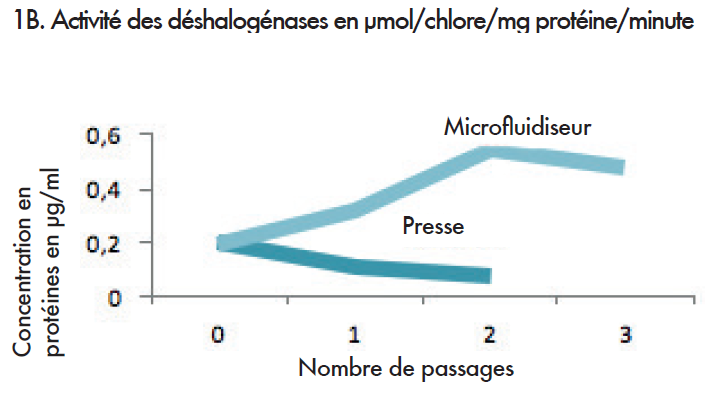
Dans le cadre de l’expérience 1A, le taux de protéines au sein de l’extrait, après le broyage, augmente après chaque passage par le microfluidiseur. Dans le cadre de l’expérience 1 B, une comparaison entre le microfluidiseur et la presse française a été effectuée.
Expérience n°2
Dans le cadre de l’expérience n°2, les chiffres indiquent que le microfluidiseur peut être utilisé pour optimiser la récupération totale de protéines, maximiser l’activité spécifique des protéines enzymatiques libérées, et augmenter la masse totale de protéines enzymatiques récupérables et utilisables. Le microfluidiseur M-120E a été utilisé dans le cadre de ces applications à 15000 psi.
Il est important de noter que le microfluidiseur M-110Y qui fonctionne entre 20000 et 23,000 psi pendant un cycle libère la même quantité de protéines que le microfluidiseur M-120E qui fonctionne à 15000 psi pendant
21 passages. Il faut également noter que l’activité spécifique des enzymes de protéines est la même lorsque la pression est plus élevée ou plus faible, mais qu’une plus grande quantité d’enzymes de protéines peut être récupérée lorsque la pression est plus élevée.
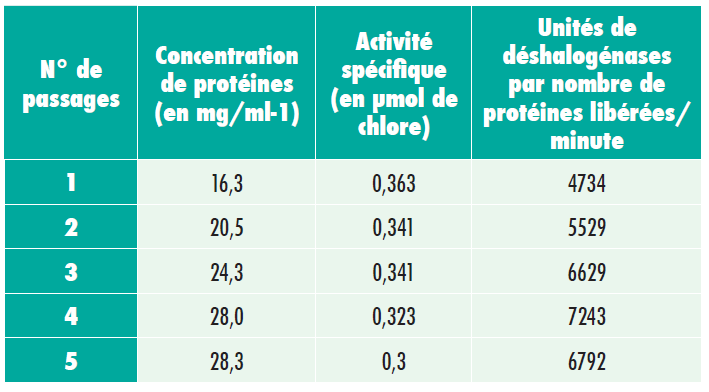
Homogénéisateur et techniques d’homogénéisation
Ce rapport est issu des données développées par Maurice Gaucher, University of Calgary, Canada. Les données suivantes comparent trois techniques de broyage mécanique – le microfluidiseur, l’homogénéisateur cellulaire de Braun, et l’homogénéisateur de Manton Gaulin.
Expérience d’homogénéisation 1
Activité des déshydrogénases de m-hydroxybenzylalcohol dans des extraits dépourvus de cellules produits par trois méthodes de broyage différentes.
L’expérience 1 indique que les trois méthodes semblent similaires en termes de capacité à broyer des cellules en fonction de la libération de protéines (en mg de protéines/g de cellules sèches).
Cependant, le microfluidiseur et la bouteille de Braun sont associés à des niveaux plus élevés d’activité enzymatique (environ 40% plus). Étant donné que la méthode de Braun convient uniquement aux préparations de faible ampleur (10 à 20 ml), la méthode retenue pour les préparations de plus grande taille est le microfluidiseur.
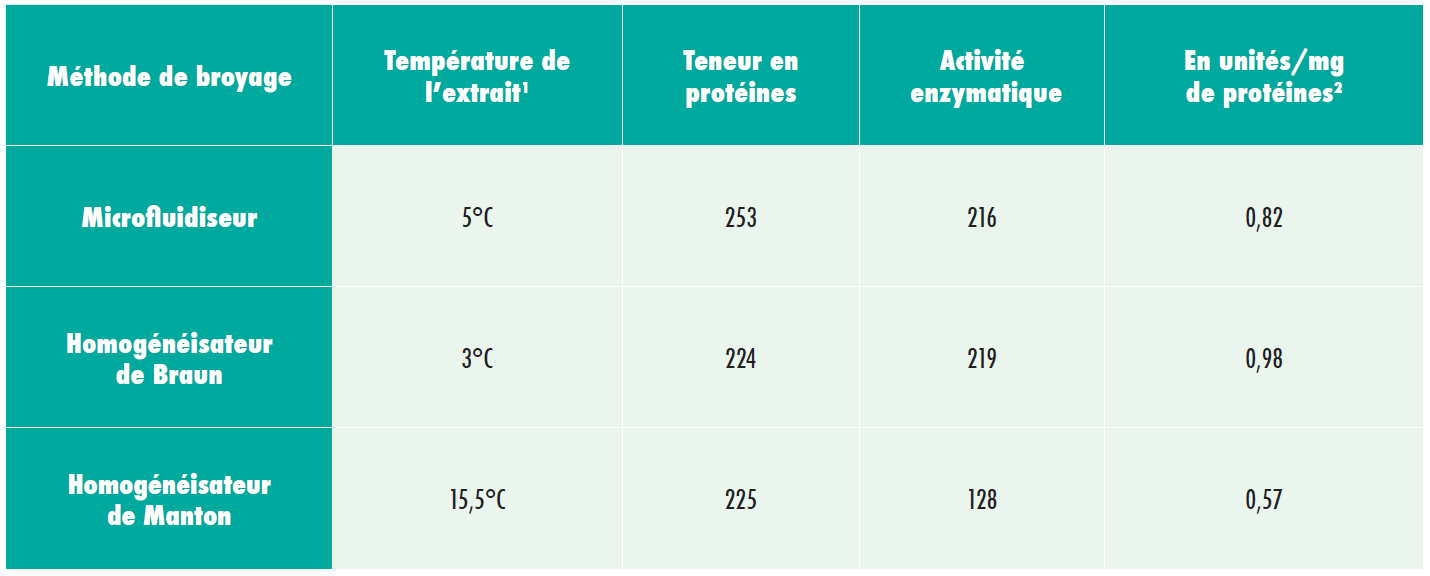
Expérience d’homogénéisation 2
Activité des synthétases d’acide m-méthylsalicylique dans des extraits dépourvus de cellules produits par trois méthodes de broyage différentes.
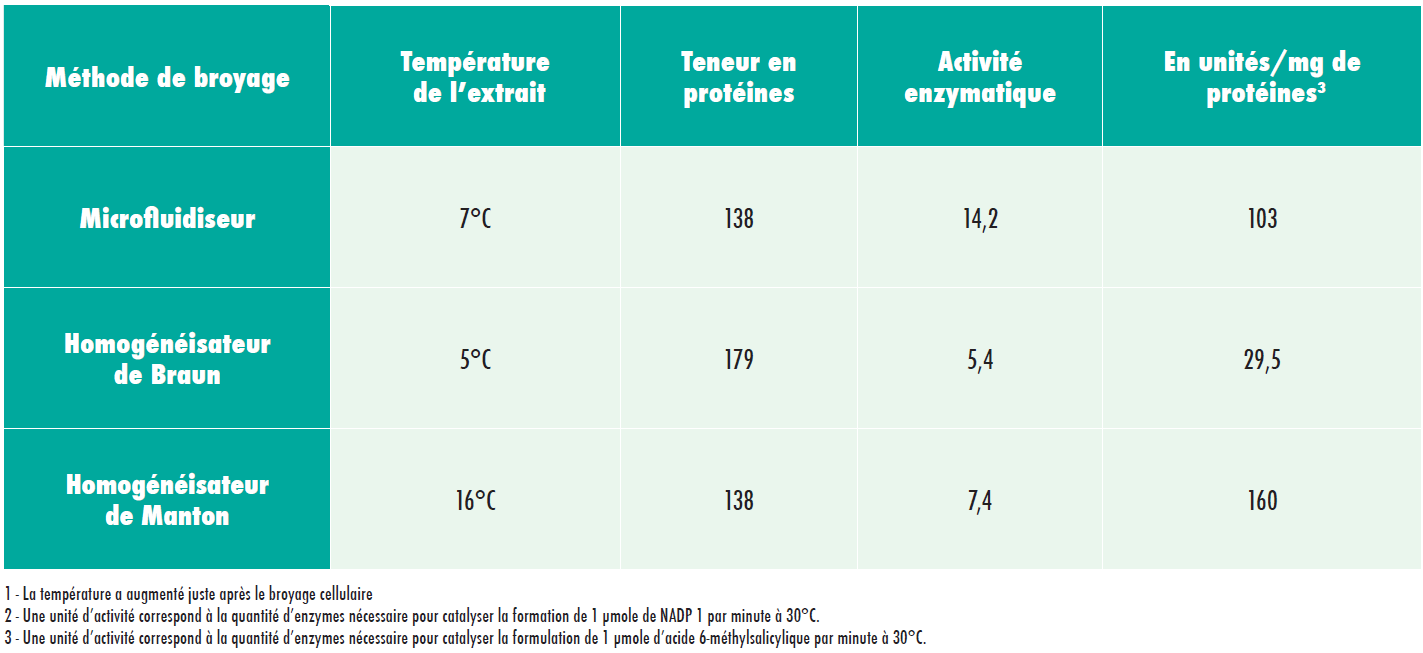
L’expérience n°2 indique que le broyage par microfluidiseur est associé à une activité enzymatique beaucoup plus élevée au sein des extraits (100 à 200% de plus), en comparaison avec les homogénéisateurs de Braun et de Manton Gaulin.
Homogénéisateur et extraction difficile
Le présent rapport est un bref récapitulatif d’un article intitulé «Evaluation of the Microfluidizer for Cell Disruption of Yeast and Chlorella», de E Llera-Santos, C.D. Copple, E.A Davis et W G. Hagar.
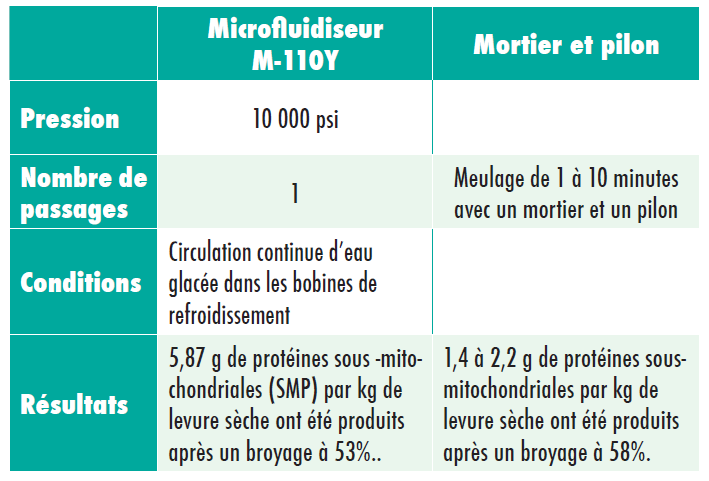
Cette application présente une extraction difficile pour les pigments photosynthétiques, étant donné qu’elle est résistante aux méthodes d’extraction standard qui impliquent un meulage avec un mortier et un pilon.
Un essai de réduction de 2,6-dichlorophénol indophénol (DCPIP) a été utilisé afin d’évaluer la fonctionnalité des membranes de thylakoïde isolées. Le colorant de l’essai est bleu dans on état oxydé, et agit comme un «dissipateur» pour le flux d’électrons du Photosystem II ; ainsi, la réduction du colorant permet de mesurer l’intégrité de la préparation de chloroplaste
Traitement
Suspensions cellulaires d’algues, Chlorella pyrenoidosa. diluées dans une solution saline tamponnée au phosphate. Production de pigments à partir de :
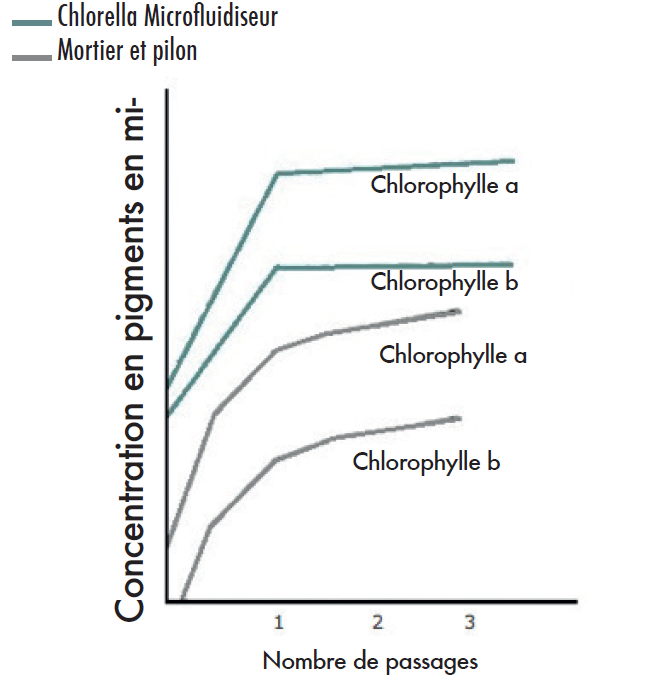
Conclusion
1 passage par le microfluidiseur a permis d’obtenir un broyage à 95%, avec une extraction quasi complète de la chlorophylle a et b. La production de pigment/cellule à l’aide du microfluidiseur a été plus de 6 fois supérieure à celle obtenue par meulage pendant 10min avec un mortier et un pilon.
Les résultats indiquent que la réduction souhaitée du DCPIP a été obtenue en 10 minutes à l’aide d’un passage de la préparation par le microfluidiseur.